

about us
厦门引路者仪器科技有限公司
厦门引路者仪器科技有限公司致力于成为世界一流的环境监测与管理的物联云方案供应商,总部位于美丽的海滨城市厦门目前公司主营物联网智能监控系统的研发和销售、冷链验证及GSP、GMP相关技术咨询服务。为医院、科研机构、医药公司等专业客户提供冷链设备、冷链监控、冷链验证服务等全程冷链管理解决方案...
verification
GSP冷链验证

验证目的:根据《药品经营质量管理规范(卫生部令第90号)》及相关附录(附录五:验证管理)中的要求,确认相关设施、设备及监测系统能够符合规定的设计标准和要求,并能安全、有效地正常运行和使用,确保药品在储存过程中的质量安全。 验证依据:1、《药品经营质量管理规范》及附录2、参照JJF1101-2003《环境试验设备温度、湿度校准规范》3、参照JJF1366-2012《温度数据采集仪校准规范》 附录5《验证管理》内容摘录如下: 冷库验证的项目至少包括: 1.温度分布特性的测试与分析,确定适宜药品存放的安全位置及区域; 2.温控设备运行参数及使用状况测试; 3.监测系统配置的测点终端参数及安装位置确认; 4.开门作业对库房温度分布及药品储存的影响; 5.确定设备故障或外部供电中断的状况下,库房保温性能及变化趋势分析; 6.对本地区的高温或低温等极端外部环境条件,分别进行保温效果评估; 7.在新建库房初次使用前或改造后重新使用前,进行空载及满载验证; 8.年度定期验证时,进行满载验证。 第七条应当根据验证对象及项目,合理设置验证测点。 (一)在被验证设施设备内一次性同步布点,确保各测点采集数据的同步、有效。 (二)在被验证设施设备内,进行均匀性布点、特殊项目及特殊位置专门布点。 (三)每个库房中均匀性布点数量不得少于9个,仓间各角及中心位置均需布置测点,每两个测点的水平间距不得大于5米,垂直间距不得超过2米。 (四)库房每个作业出入口及风机出风口至少布置5个测点,库房中每组货架或建筑结构的风向死角位置至少布置3个测点。

验证目的: 根据《药品经营质量管理规范(卫生部令第90号)》及相关附录(附录五:验证管理)中的要求,确认相关设施、设备及监测系统能够符合规定的设计标准和要求,并能安全、有效地正常运行和使用,确保药品在储存过程中的质量安全。验证依据:1、《药品经营质量管理规范》及附录2、参照JJF1101-2003《环境试验设备温度、湿度校准规范》3、参照JJF1366-2012《温度数据采集仪校准规范》 附录5《验证管理》内容摘录如下: 冷藏(低温)车验证的项目至少包括: 1.车厢内温度分布特性的测试与分析,确定适宜药品存放的安全位置及区域; 2.温控设施运行参数及使用状况测试; 3.监测系统配置的测点终端参数及安装位置确认; 4.开门作业对车厢温度分布及变化的影响; 5.确定设备故障或外部供电中断的状况下,车厢保温性能及变化趋势分析; 6.对本地区高温或低温等极端外部环境条件,分别进行保温效果评估; 7.在冷藏车初次使用前或改造后重新使用前,进行空载及满载验证; 8.年度定期验证时,进行满载验证。 第七条应当根据验证对象及项目,合理设置验证测点。 (一)在被验证设施设备内一次性同步布点,确保各测点采集数据的同步、有效。 (二)在被验证设施设备内,进行均匀性布点、特殊项目及特殊位置专门布点。 (五)每个冷藏车箱体内测点数量不得少于9个,每增加20立方米增加9个测点,不足20立方米的按20立方米计算。
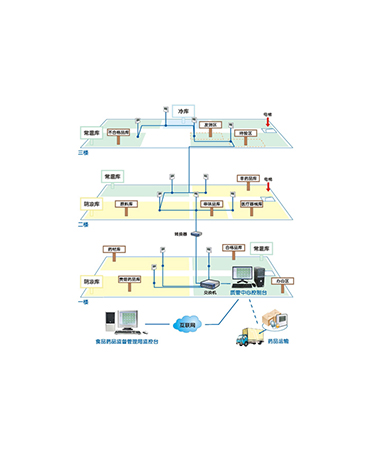
验证目的: 根据《药品经营质量管理规范(卫生部令第90号)》及相关附录(附录五:验证管理)中的要求,确认相关设施、设备及监测系统能够符合规定的设计标准和要求,并能安全、有效地正常运行和使用,确保药品在储存过程中的质量安全。 验证依据:1、《药品经营质量管理规范》及附录2、参照JJF1101-2003《环境试验设备温度、湿度校准规范》3、参照JJF1366-2012《温度数据采集仪校准规范》 附录5《验证管理》内容摘录如下: 监测系统验证的项目至少包括: 1.采集、传送、记录数据以及报警功能的确认; 2.监测设备的测量范围和准确度确认; 3.测点终端安装数量及位置确认; 4.监测系统与温度调控设施无联动状态的独立安全运行性能确认; 5.系统在断电、计算机关机状态下的应急性能确认; 6.防止用户修改、删除、反向导入数据等功能确认。 附录3、温湿度自动监测 第一条企业应当按照《药品经营质量管理规范》(以下简称《规范》)的要求,在储存药品的仓库中和运输冷藏、冷冻药品的设备中配备温湿度自动监测系统(以下简称系统)。系统应当对药品储存过程的温湿度状况和冷藏、冷冻药品运输过程的温度状况进行实时自动监测和记录,有效防范储存运输过程中可能发生的影响药品质量安全的风险,确保药品质量安全。 第二条系统由测点终端、管理主机、不间断电源以及相关软件等组成。各测点终端能够对周边环境温湿度进行数据的实时采集、传送和报警;管理主机能够对各测点终端监测的数据进行收集、处理和记录,并具备发生异常情况时的报警管理功能。 第三条系统温湿度数据的测定值应当按照《规范》第八十三条的有关规定设定。 系统应当自动生成温湿度监测记录,内容包括温度值、湿度值、日期、时间、测点位置、库区或运输工具类别等。 第四条系统温湿度测量设备的最大允许误差应当符合以下要求: (一)测量范围在0℃~40℃之间,温度的最大允许误差为±0.5℃; (二)测量范围在-25℃~0℃之间,温度的最大允许误差为±1.0℃; (三)相对湿度的最大允许误差为±5%RH。 第五条系统应当自动对药品储存运输过程中的温湿度环境进行不间断监测和记录。 系统应当至少每隔1分钟更新一次测点温湿度数据,在药品储存过程中至少每隔30分钟自动记录一次实时温湿度数据,在运输过程中至少每隔5分钟自动记录一次实时温度数据。当监测的温湿度值超出规定范围时,系统应当至少每隔2分钟记录一次实时温湿度数据。 第六条当监测的温湿度值达到设定的临界值或者超出规定范围,系统应当能够实现就地和在指定地点进行声光报警,同时采用短信通讯的方式,向至少3名指定人员发出报警信息。 当发生供电中断的情况时,系统应当采用短信通讯的方式,向至少3名指定人员发出报警信息。 第七条系统各测点终端采集的监测数据应当真实、完整、准确、有效。 (一)测点终端采集的数据通过网络自动传送到管理主机,进行处理和记录,并采用可靠的方式进行数据保存,确保不丢失和不被改动。 (二)系统具有对记录数据不可更改、删除的功能,不得有反向导入数据的功能。 (三)系统不得对用户开放温湿度传感器监测值修正、调整功能,防止用户随意调整,造成监测数据失真。 第八条企业应当对监测数据采用安全、可靠的方式按日备份,备份数据应当存放在安全场所,数据保存时限符合《规范》第四十二条的要求。 第九条系统应当与企业计算机终端进行数据对接,自动在计算机终端中存储数据,可以通过计算机终端进行实时数据查询和历史数据查询。 第十条系统应当独立地不间断运行,防止因供电中断、计算机关闭或故障等因素,影响系统正常运行或造成数据丢失。 第十一条系统保持独立、安全运行,不得与温湿度调控设施设备联动,防止温湿度调控设施设备异常导致系统故障的风险。 第十二条企业应当对储存及运输设施设备的测点终端布点方案进行测试和确认,保证药品仓库、运输设备中安装的测点终端数量及位置,能够准确反映环境温湿度的实际状况。 第十三条药品库房或仓间安装的测点终端数量及位置应当符合以下要求: (一)每一独立的药品库房或仓间至少安装2个测点终端,并均匀分布。 (二)平面仓库面积在300平方米以下的,至少安装2个测点终端;300平方米以上的,每增加300平方米至少增加1个测点终端,不足300平方米的按300平方米计算。 平面仓库测点终端安装的位置,不得低于药品货架或药品堆码垛高度的2/3位置。 (三)高架仓库或全自动立体仓库的货架层高在4.5米至8米之间的,每300平方米面积至少安装4个测点终端,每增加300平方米至少增加2个测点终端,并均匀分布在货架上、下位置;货架层高在8米以上的,每300平方米面积至少安装6个测点终端,每增加300平方米至少增加3个测点终端,并均匀分布在货架的上、中、下位置;不足300平方米的按300平方米计算。 高架仓库或全自动立体仓库上层测点终端安装的位置,不得低于最上层货架存放药品的最高位置。 (四)储存冷藏、冷冻药品仓库测点终端的安装数量,须符合本条上述的各项要求,其安装数量按每100平方米面积计算。 第十四条每台独立的冷藏、冷冻药品运输车辆或车厢,安装的测点终端数量不得少于2个。车厢容积超过20立方米的,每增加20立方米至少增加1个测点终端,不足20立方米的按20立方米计算。 每台冷藏箱或保温箱应当至少配置一个测点终端。 第十五条测点终端应当牢固安装在经过确认的合理位置,避免储运作业及人员活动对监测设备造成影响或损坏,其安装位置不得随意变动。 第十六条企业应当对测点终端每年至少进行一次校准,对系统设备应当进行定期检查、维修、保养,并建立档案。 第十七条系统应当满足相关部门实施在线远程监管的条件。

验证目的:根据《药品经营质量管理规范(卫生部令第90号)》及相关附录(附录五:验证管理)中的要求,确认相关设施、设备及监测系统能够符合规定的设计标准和要求,并能安全、有效地正常运行和使用,确保药品在储存过程中的质量安全。验证依据:1、《药品经营质量管理规范》及附录2、参照JJF1101-2003《环境试验设备温度、湿度校准规范》3、参照JJF1366-2012《温度数据采集仪校准规范》 附录5《验证管理》内容摘录如下: 冷藏箱或保温箱验证的项目至少包括: 1.箱内温度分布特性的测试与分析,分析箱体内温度变化及趋势; 2.蓄冷剂配备使用的条件测试; 3.温度自动监测设备放置位置确认; 4.开箱作业对箱内温度分布及变化的影响; 5.高温或低温等极端外部环境条件下的保温效果评估; 6.运输最长时限验证。 第七条应当根据验证对象及项目,合理设置验证测点。 (一)在被验证设施设备内一次性同步布点,确保各测点采集数据的同步、有效。 (二)在被验证设施设备内,进行均匀性布点、特殊项目及特殊位置专门布点。 (六)每个冷藏箱或保温箱的测点数量不得少于5个。 第八条应当确定适宜的持续验证时间,以保证验证数据的充分、有效及连续。 (三)冷藏箱或保温箱经过预热或预冷至规定温度并满载装箱后,按照最长的配送时间连续采集数据。
solutions
冷链解决方案
solutions
行业法规
医药产品冷链物流温控设施设备验证 性能确认技术规范
食品药品监管总局 国家卫生计生委关于贯彻实施新修订《疫苗流通和预防接种管理条例》的通知
疫苗储存和运输管理规范(2017年版)
partner
合作伙伴
-
-

-

-




























